前面提到,铁生锈几乎都是由于电化学反应而导致,那么电化学反应是怎么一回事呢......
电化学反应:
它必定是氧化还原反应,这个过程有物质被反应掉,也有物质被还原,且同时伴有电子流动,产生电流。同时有电能和化学能转化的反应属于电化学反应,它是化学反应的一个分支学科。
锈蚀的4个条件(昨天已提到过):
阳极:在同一个电化学反应中,电位较低的金属或区域。
阴极:在同一个电化学反应中,电位较高的金属或区域。
金属通道:传导电子的金属路径。
电解液:溶解阳极金属并传导离子的一种液体介质。
铁的电化学反应过程:
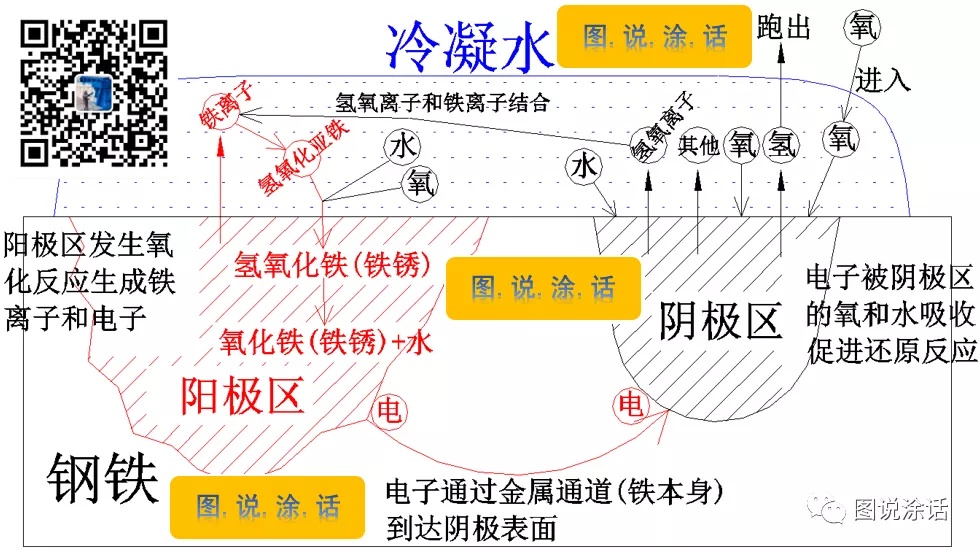
1、当铁表面存在凝露水(电解液)时,这种水具有溶解能力,它会把铁原子溶解为铁离子和电子。
2、铁本身由于各种原因(如:存在杂质、轧制不均),任何两个靠在一起的铁原子的电位都有可能不同,从而形成了电位差,在电场力作用的驱动下,电位较低的铁(阳极)的电子会跑掉,通过金属通道达到电位较高的铁(阴极)。
3、电子到达阴极铁时,会被阴极铁附近可被还原的物质(氧气、水、氢离子等)吸收,生成氢气和氢氧离子(阴离子)等物质(发生了还原反应);
4、氢气会挥发掉,氢氧离子(阴离子)会和阳极区的铁离子(阳离子)生成氢氧化亚铁;
5、氢氧化亚铁会和水及氧气生成氢氧化铁,部分氢氧化铁脱水后生产氧化铁和水。
!!!氢氧化铁和氧化铁就是主要的锈蚀产物——铁锈。